共价键
碳原子为四价,其电子排布为1s22s22p2。碳原子通过其4个外层电子即价电子与其他原子的价电子共享电子对,生成具有稀有气体外层电子构型的稳定分子。
碳原子能够与其他碳原子通过单键、双键或三键相互结合形成各种链状或环状结构,碳原子还能与氢、氧、硫、氮、磷、卤素等许多其他元素的原子通过化学键相结合。构成有机分子最主要的化学键是共价键。
一、Lewis共价键理论
同种元素或电负性相近元素的原子之间可以通过共用电子对形成分子,通过共用电子对形成的化学键称为共价键(covalent bond)。
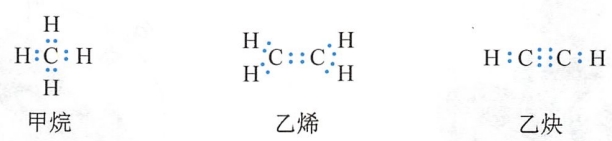
分子中,每个原子均应具有稳定的稀有气体原子的8电子外层电子构型(He为2电子)的规律习惯上称为八隅律(octet rule)。例如:
电子,每个碳原子又分别与1个氢原子共享1对电子。甲烷、乙烯和乙炔分子中的碳原子和氢原子均形成了稀有气体外电子层构型(碳的外电子层含8个电子,氢的外电子层含2个电子),符合八隅律。
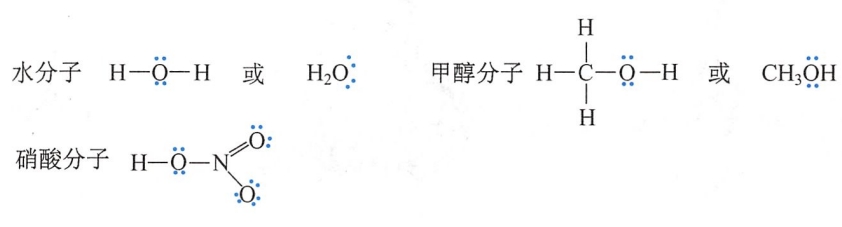
这种用电子对表示共价键结构的化学式称为Lewis结构式,其简化式的表示方式为:标出或省略分子中的孤对电子(未共享电子对),成键电子对(共价键)用短直线表示(或省略短直线)。水分子、甲醇分子和硝酸分子的Lewis简化式为:
二、现代共价键理论
现代共价键理论的基本要点是:当两个原子互相接近到一定距离时,两个自旋方向相反的单电子相互配对,形成了密集于两核之间的电子云。该电子云一方面通过降低两原子核间正电荷的排斥力使体系能量降低,另一方面通过分别吸引两原子核形成稳定的共价键。
每个原子所能形成共价键的数目取决于该原子中单电子的数目,即一个原子含有几个单电子,就能与其他原子的几个自旋方向相反的单电子形成共价键,该性质是共价键的饱和性;
形成共价键的原子轨道重叠程度越大,核间电子云越密集,形成的共价键就越稳定。因此,原子总是尽可能地沿着原子轨道最大重叠方向形成共价键,该性质决定了共价键的方向性。共价键的方向性使构成共价分子的各原子具有一定的空间构型,例如:甲烷分子的4个氢原子构成的空间结构为正四面体型。
三、碳的杂化轨道
杂化轨道理论:在形成分子时,形成分子的各原子相互影响,使得同一个原子内不同类型能量相近的原子轨道重新组合,形成数量相同但能量、形状和空间方向与原来轨道不同的新原子轨道。这种原子轨道重新组合的过程称为杂化,所形成的新原子轨道称为杂化轨道(hybrid orbital)。
有机化合物中,碳原子有sp3、sp2和sp三种杂化轨道。
(一)sp3杂化轨道
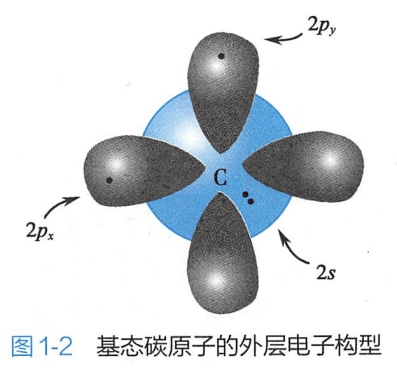
基态碳原子外层的电子构型为2s22p1x2p1y2p0z,即球形的2s轨道有两个电子,相互垂直的哑铃形的2px和2py,轨道各有一个电子,2pz轨道是空的(图1-2)。
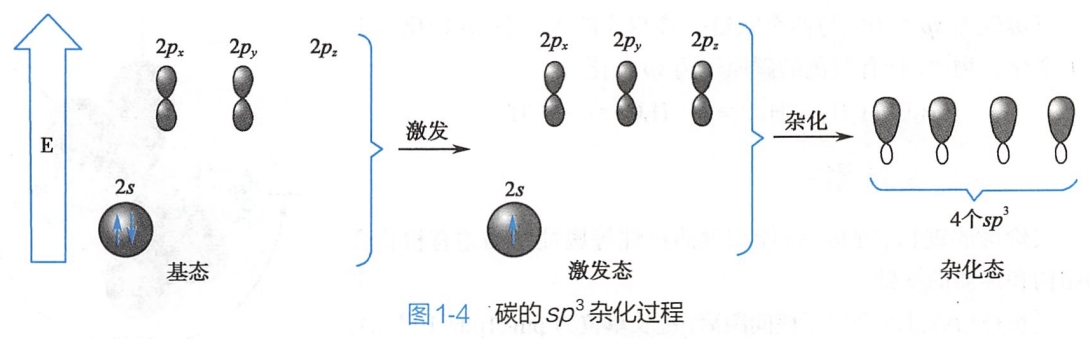
依据鲍林的杂化轨道理论,碳原子与氢原子成键时,在氢原子的影响下,碳的2s轨道中的一个电子被激发到原来空的2pz轨道,形成碳原子的激发态。此时,一个2s轨道和三个2p轨道各有一个电子,这4个轨道发生杂化,形成4个相同的sp3杂化轨道。sp3杂化轨道类似葫芦,一头大一头小。
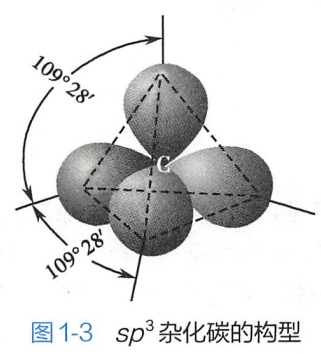
sp3杂化碳的结构为正四面体型(图1-3),碳原子核位于正四面体的中心,四个sp3杂化轨道环绕在碳原子核的周围,指向正四面体的四个顶点,相邻两个杂化轨道间的夹角均为109°28'。碳的sp3杂化过程见图1-4。
(二)sp2杂化轨道
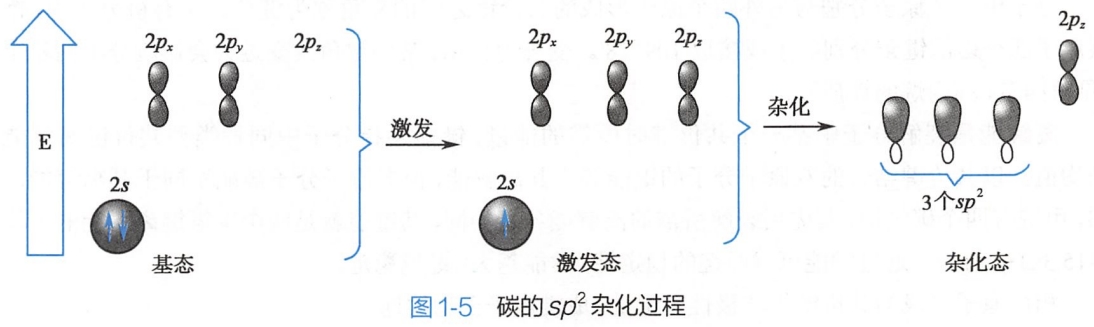
碳原子形成双键的过程中,基态碳原子2s轨道中的一个电子被激发到空的2pz轨道,碳原子转变为激发态;激发态碳原子2s轨道(含一个单电子)与两个2p轨道相互杂化,形成三个相同的sp2杂化轨道,碳原子还剩一个未参与杂化的2p轨道。sp2杂化轨道的形状也类似葫芦,一头大一头小,但比sp3杂化轨道略短。此杂化过程见图1-5。
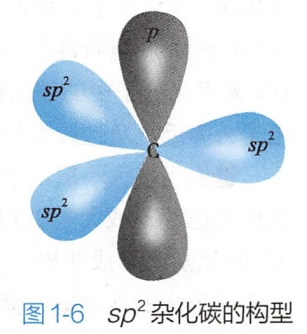
sp2杂化碳原子的三个sp2杂化轨道处于同一平面,其夹角为120°,余下的一个未参与杂化的p轨道垂直于三个sp2杂化轨道所在的平面(图1-6)。
(三)sp杂化轨道
碳原子形成碳碳三键的过程中,基态碳原子的2s轨道中的一个电子被激发到空的2pz轨道,碳原子形成激发态,激发态2s轨道与一个2p轨道杂化,形成两个相同的sp杂化轨道,碳原子还剩余两个互相垂直的卫轨道(图1-7)。
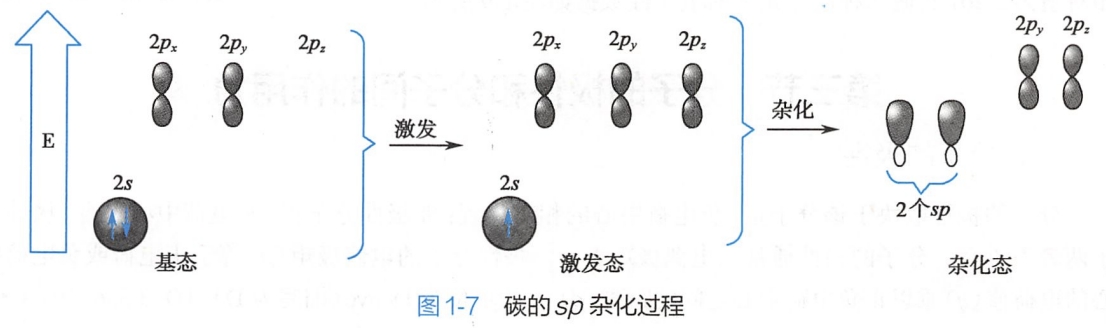
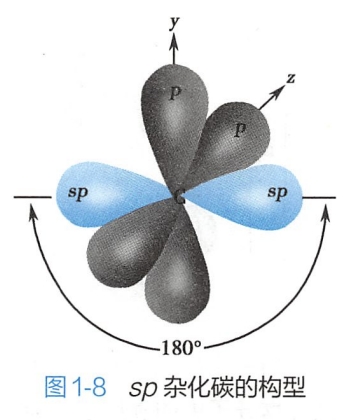
sp杂化轨道形状也类似葫芦,但比sp2杂化轨道稍短。sp杂化碳原子的两个sp杂化轨道呈直线形,夹角为180°。碳原子余下的两个互相垂直的p轨道,均垂直于sp杂化轨道(图1-8)。
四、共价键的属性
共价键的键长、键角、键能和键的极性等属性是描述有机化合物结构和性质的基础。
键长是指成键两个原子核间距离,键长单位为pm(1pm=10-12m)。共价键的键长主要取决于两个原子的成键类型,而受邻近原子或基团的影响较小。碳碳双键比碳碳单键的键长短,而比碳碳三键的键长长。应用X-射线衍射等物理方法,可以测定键长。
分子中一个原子分别与另外两个原子形成的共价键之间的夹角称为键角。在有机分子中,饱和碳原子四个键的键角分别等于或接近109°28'。受外力作用,某些键角改变过大会影响分子的稳定性(见第四章,环丙烷的性质)。
离解能是裂解分子中某一个共价键时所需的能量,键能是指分子中同种类型共价键离解能的平均值。以共价键结合的双原子分子的键能等于其离解能,但多原子分子键能不同于其离解能。例如,甲烷有四个碳氢键,其先后裂解所需的离解能各不相同,其键能就是四个碳氢键离解能的平均值(415.3 kJ.mol)。通过键能可判断键的稳定性,键能越大,键越稳定。
相同原子形成的共价键为非极性共价键,成键电子云均等地分配在两个原子之间;电负性不同的原子形成的共价键为极性共价键,成键电子云靠近电负性较大的原子,使其带部分负电荷;电负性较小的原子带部分正电荷。例如,氯甲烷分子中的碳氯键(CH3CI)为极性共价键,其成键电子云靠近电负性较大的氯原子。
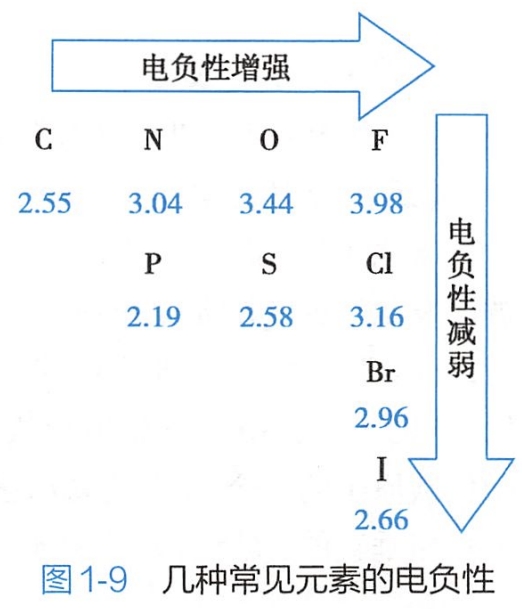
键的极性大小取决于成键两个原子的电负性差异。一般,电负性差值等于或大于1.7的元素间形成离子键;电负性差值小于 0.7的元素间形成非极性共价键,电负性差值在0.7~1.7的两种元素间形成的共价键为极性共价键。有机化合物中,H的电负性相对值为2.20,其他几种常见元素的电负性数据如图1-9所示。